oxygène

Corps gazeux diatomique (O2) constituant en volume le cinquième de l'atmosphère terrestre et nécessaire à la respiration. Dans le langage courant, on parle abusivement d’« oxygène » pour désigner en réalité le dioxygène (gaz diatomique composé de deux atomes d’oxygène). Le terme « oxygène » devrait être réservé à l’élément chimique de symbole O.
- Numéro atomique : 8
- Masse atomique : 15,999 4
- Température de fusion : − 218,4 °C
- Température d'ébullition : − 182,96 °C
- Densité : 1,105
CHIMIE
1. Découverte de l’oxygène


L'oxygène fut découvert sous sa forme gazeuse (ou dioxygène) indépendamment par Carl Wilhelm Scheele en 1773 (mais il ne publia ses résultats qu’en 1777) et Joseph Priestley en 1774. L’histoire retient les noms des deux chimistes et la date de la première publication (1774). Toutefois, ni l’un ni l’autre ne se rendent compte de l’importance de leur découverte, en particulier pour expliquer les réactions de combustion qui impliquent la présence de dioxygène. C’est Antoine Laurent de Lavoisier qui établit les propriétés principales de ce gaz à partir de 1775. Il montra qu'il y avait de l’oxygène dans l'air et dans l'eau, et fit ressortir son rôle dans les combustions et la respiration. En démontrant que la combustion est un processus dans lequel une substance se combine avec le dioxygène, Lavoisier réfute la théorie du phlogistique (substance inventée près d'un siècle plus tôt par les chimistes allemands Johann Becher et Georg Stahl pour expliquer le phénomène de combustion) et contribue ainsi à l'avènement de la chimie moderne.

Par ailleurs, Lavoisier lui donna le nom « oxygène » (du grec oxys et genes, signifiant « qui produit de l’acide », parce l'oxygène apparaissait dans tous les acides connus à cette époque. Il montre également que l'oxygène de l'air se présente sous la forme d'un gaz diatomique (composé de 2 atomes d'oxygène, d'où sa formule chimique O2), et que c'est un élément chimique (corps pur simple).
2. État naturel de l’oxygène

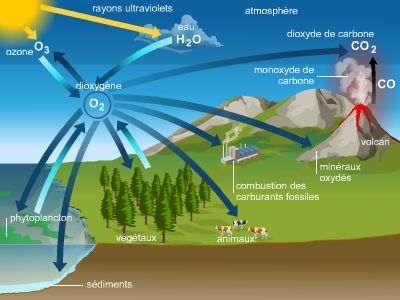
L’oxygène est l’élément chimique le plus abondant sur Terre. En effet, la teneur en oxygène de l’atmosphère s’élève à environ 23 % (en masse), celle des océans à 86 %, celle de la croûte terrestre à 47 % et celle du corps humain à 60 %. On distingue généralement deux formes principales d’oxygène :
• l’oxygène sous forme élémentaire, c’est-à-dire sous forme de molécules constituées uniquement d’oxygène comme le dioxygène (O2) de l’air que l’on respire, ou l’ozone (O3) qui forme une couche fragile et vitale pour les êtres vivants car elle stoppe les rayonnements ultraviolets (UV) nocifs du Soleil ;
• l’oxygène sous forme de composés minéraux et organiques, appelés oxydes : la majorité des composés formés par l’oxygène sont des oxydes entrant dans la composition chimique des roches et des minéraux (silicates et carbonates), comme le quartz (dioxyde de silicium, de formule SiO2), l’hématite (Fe2O3), etc. Par ailleurs, l’oxygène apparaît dans la composition chimique d’une large gamme de composés organiques, tels que le dioxyde de carbone (CO2), l’éthanol (C2H5OH), l’aspirine (C9H8O4), le glucose (C6H12O6), etc.
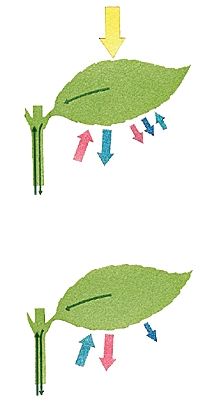
L'oxygène est un élément constitutif fondamental de la matière vivante, au même titre que le carbone, l'hydrogène et l'azote. C’est d’ailleurs l’un des constituants de l’ADN (molécule portant les informations génétiques dans les cellules des êtres vivants). Par ailleurs, l’oxygène est essentiel au cycle de la vie, car il intervient dans les processus biologiques fondamentaux que sont la photosynthèse (production de dioxygène par les plantes) et la respiration (absorption de dioxygène et rejet de dioxyde de carbone par les êtres vivants).
3. Propriétés chimiques et physiques de l'oxygène
L'oxygène est, après le fluor, l'élément qui possède la plus forte électronégativité. Il a ainsi tendance à former l'anion O2− (dans les oxydes métalliques), à former, en combinaison avec les non-métaux, deux liaisons de covalence (H2O par exemple) ou à jouer le rôle d'accepteur en fixant un doublet d'électrons. Beaucoup de réactions auxquelles il participe sont exothermiques (réactions qui dégagent de la chaleur). Sa fixation est dite « combustion », en raison de la chaleur qu'elle dégage en général ; suivant les cas, cette combustion peut être vive ou lente. À l'exception des halogènes et de l'azote, tous les non-métaux peuvent brûler dans le dioxygène en donnant les oxydes les plus stables (H2O, SO2, etc.). Hormis l'or et le platine, les métaux peuvent également brûler dans le dioxygène, notamment les métaux alcalins et alcalino-terreux, le magnésium, l'aluminium, le zinc, le fer, etc. Beaucoup de métaux s'oxydent aussi à froid dans l'air, mais leur corrosion fait souvent intervenir la vapeur d'eau et le gaz carbonique de l'air.
Du point de vue de ses caractéristiques physiques, le dioxygène est un gaz incolore, inodore et sans saveur. Quand il est liquéfié (mis sous forme liquide), il est de couleur bleu pâle et devient légèrement magnétique. Dans les conditions normales de température et de pression (1 atm, 0 °C), l’oxygène bout à - 182,9 °C et fond à - 218,4 °C.
4. Les réactions de combustion

Les composés formés d'éléments combustibles sont en général eux-mêmes combustibles, notamment les combinaisons d'hydrogène et de carbone, c'est-à-dire les corps organiques. Leur combustion fournit de la vapeur d'eau et du gaz carbonique, mais, si le dioxygène est en quantité insuffisante, l'hydrogène brûle avant le carbone, qui se retrouve sous forme de noir de fumée. Il en est de même des composés du soufre, du phosphore, des métaux. De nombreux composés peuvent aussi subir une oxydation lente ; grâce à certains ferments, l'ammoniac se transforme en oxydes d'azote ; l'alcool éthylique, en acide acétique, etc.
Enfin, la respiration produit elle-même une oxydation de substances organiques dans les tissus vivants, ensemble de réactions qui libèrent l'énergie dont ceux-ci ont besoin.
5. Préparation et utilisations de l'oxygène
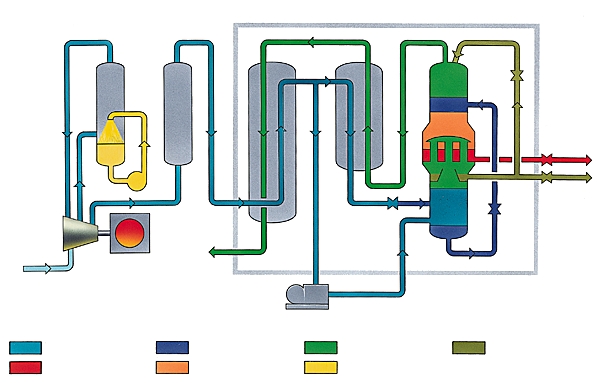
Dans l'industrie, on prépare le dioxygène, en même temps que le diazote, par distillation fractionnée de l'air liquide. Il est stocké et livré gazeux dans des tubes d'acier, sous une pression de 200 bars, ou sous forme liquide dans des récipients isolants.
Le dioxygène est un produit d'une grande importance industrielle et pratique : sa production, à l'échelle mondiale, est d'environ 100 millions de tonnes par an, et la France y joue un rôle de premier plan en tant que producteur.
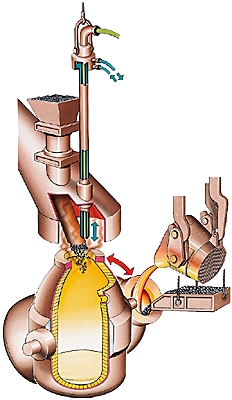
Depuis les années 1950, le dioxygène est utilisé à la place de l'air pour l'affinage de la fonte par oxydation contrôlée : cette opération permet d'éliminer partiellement le carbone de la fonte sortant du haut fourneau, et presque totalement le phosphore et le soufre, pour produire l'acier. Pour cette utilisation, un réseau d'oxyducs de 3 000 km a été construit en Europe occidentale.
Le dioxygène est également utilisé comme comburant dans les fusées spatiales (où il est stocké sous forme liquide) et dans les chalumeaux (soudage, oxycoupage, perforation du béton…). Il intervient aussi dans différentes applications médicales, où il est utilisé dans les traitements d’insuffisances respiratoires et en réanimation.
6. L'oxygène dans le corps humain
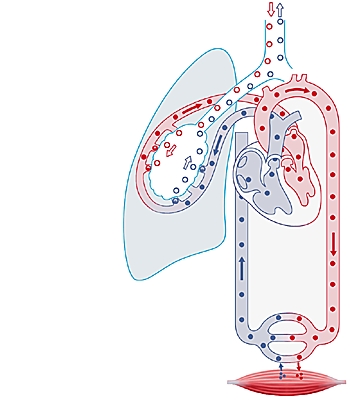
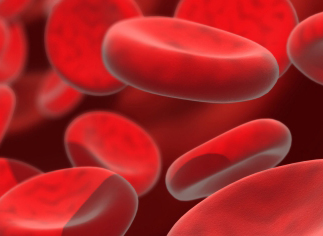
Dans l'organisme, le dioxygène est véhiculé dans le sang après fixation sur l'hémoglobine des globules rouges. Ce dioxygène est cédé aux tissus, où il intervient dans la « respiration cellulaire » (réactions d'oxydoréduction productrices d'énergie).
On définit le taux sanguin d'oxygène par sa pression partielle (la pression partielle d'un gaz dans un mélange gazeux occupant un volume déterminé est égale à la pression qu'exercerait ce gaz s'il occupait seul ce volume). La pression partielle d'oxygène artériel (PaO2) est normalement de 90 à 100 millimètres de mercure, sachant qu'elle diminue avec l'âge. L'hypoxie (oxygénation insuffisante des tissus) entraîne un trouble de fonctionnement des cellules, pouvant aboutir à leur mort.