distillation
(latin médiéval distillatio, -onis)

Action de distiller ; procédé de séparation des constituants d'un mélange par ébullition.
CHIMIE
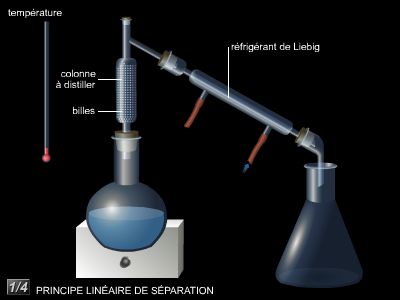
La distillation est un processus physique qui consiste à séparer, par la chaleur, les différents éléments constituant un liquide ou un solide, et à les recueillir sous forme gazeuse. Cette vaporisation peut être suivie d’une condensation par refroidissement (liquéfaction).
Pendant près de mille ans, la distillation a été utilisée pour la purification des liquides et l’extraction des parfums des plantes. Aujourd’hui, ce procédé est employé pour le raffinage du pétrole, la fabrication d’alcools et de nombreux produits industriels ou métallurgiques.
L'appareillage de distillation
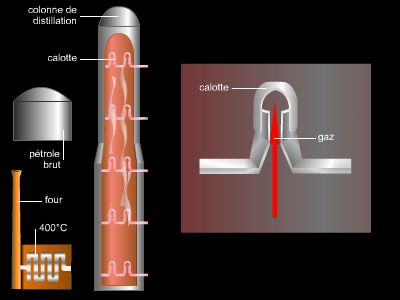
L’appareillage utilisé pour la distillation est l’alambic, qui se compose de deux éléments : le premier (la chaudière) est un réservoir dans lequel le liquide est chauffé et vaporisé ; le second (le condenseur) est un tube, relié au réservoir, dans lequel la vapeur se refroidit et se condense (liquéfaction). Des gouttes de liquide se forment sur les parois du condenseur, puis tombent ensuite lentement dans un autre réservoir, le récepteur.
Applications et procédés
La purification de l’eau
Les batteries d’automobiles, et certains appareils utilisés dans l’industrie chimique, exigent une eau très pure, ne contenant aucun sel minéral, et qui ne peut donc être fournie par les rivières, les puits ou les réservoirs. On purifie donc l’eau par distillation : on chauffe l’eau minérale pour que l’eau s’évapore, tandis que les sels restent au fond de la chaudière ; la vapeur est refroidie, elle se condense et retourne à l’état liquide dans le condenseur ; on récupère de l’eau déminéralisée (le distillat). On peut également employer ce procédé pour obtenir de l’eau douce à bord des navires. Certaines usines de dessalage de l’eau de mer fonctionnent suivant les mêmes principes.
La séparation des composants d’un mélange : la distillation simple
Un liquide est parfois constitué par un mélange de plusieurs liquides. C’est ainsi que le vin est composé d’alcool et d’eau, et le pétrole, d’essence, de kérosène et de plusieurs espèces d’hydrocarbures, légers ou lourds. Ces différents composants liquides peuvent être séparés par distillation : grâce à un contrôle rigoureux de la température, l’un des liquides peut être vaporisé avant un autre dont la température propre d’ébullition n’est pas encore atteinte. Par exemple, dans le cas d'une distillation d'un mélange d’alcool méthylique (alcool de bois) et d’eau, l’alcool méthylique bout à 65 °C, et l’eau à 100 °C. Si ce mélange est chauffé un peu au-delà de 65 °C, l’alcool méthylique se vaporisera le premier : une fois la vapeur condensée, on recueillera, dans le récepteur, de l’alcool méthylique presque pur (le liquide distillé contiendra une très petite quantité d’eau, due aux retombées de vapeur). Ce procédé, employé pour les liquides dont les points d’ébullition sont très différents, est appelé distillation simple.
La distillation fractionnée
Lorsqu’il s’agit de séparer, dans un mélange, deux liquides ou plus, on a recours à la distillation fractionnée. Au fur et à mesure de l’échauffement du mélange, chacun des composants se met à bouillir lorsqu’il atteint son point particulier d’ébullition. Les vapeurs obtenues sont alors condensées et recueillies dans des condenseurs et des récepteurs distincts. Cette méthode permet donc la séparation d’un mélange liquide en portions, appelées fractions. Ainsi, dans la distillation d’un mélange d’alcool éthylique et d’eau, la portion qui bout en deçà de 76,7 °C peut être une fraction, celle qui bout entre 82,2 °C et 100 °C en est une autre.
Les fractions sont généralement des mélanges, mais elles peuvent être des substances pures.
L’industrie, et plus particulièrement la métallurgie, utilise également la condensation fractionnée. Le mélange à distiller est chauffé jusqu’à la vaporisation de la plupart de ses composants. La vapeur monte dans une colonne où chaque fraction se condense à des points différents. Les fractions aux températures d’ébullition élevées se condensent les premières à la base de la colonne. Celles dont la température d’ébullition est plus basse doivent monter davantage avant de se refroidir suffisamment pour se condenser.
La distillation sous pression réduite
Certains liquides ne peuvent pas être distillés par des méthodes classiques, car ils seraient détruits par la température avant d’atteindre leurs points d’ébullition : c’est le cas des huiles lubrifiantes. L’ingénieur chimiste doit recourir à la distillation dans le vide partiel : en diminuant la pression d’un liquide, il est possible d’abaisser le point d’ébullition, de sorte que la vaporisation se produit à une température inférieure à celle de destruction.
Lorsque la distillation est effectuée sous un vide presque total, le procédé est appelé distillation moléculaire. Ce type de distillation est notamment utilisé de manière industrielle pour la purification des vitamines.
La distillation par la vapeur
La distillation par la vapeur est parfois employée pour des corps dont les températures d’ébullition sont basses, et qui s’altèrent facilement sous l’action de la chaleur. De la vapeur étant injectée sous pression dans l’alambic, la chaleur dégagée vaporise le liquide à distiller. Une fois la condensation effectuée, la vapeur se transforme en eau dans le condenseur. Ce procédé est réservé aux liquides non miscibles à l’eau, tels que les parfums et les huiles odorantes des plantes.
La distillation sèche ou destructive
La distillation sèche, ou distillation destructive, est utilisée pour séparer les produits chimiques liquides contenus dans des matériaux solides. On peut ainsi obtenir, à partir du bois, par calcination, de la créosote (un mélange de phénols), de l’alcool méthylique et de nombreux autres produits.
La distillation de la houille, selon ce même procédé, conduit à la production de gaz domestique, de goudron...
Certains solides, lorsqu’ils sont soumis à l’action de la chaleur, au lieu de former un liquide, se transforment directement en vapeur : c’est la sublimation, qui constitue un procédé de distillation employé notamment pour la purification de l’iode solide ou du soufre.
PÉTROLE
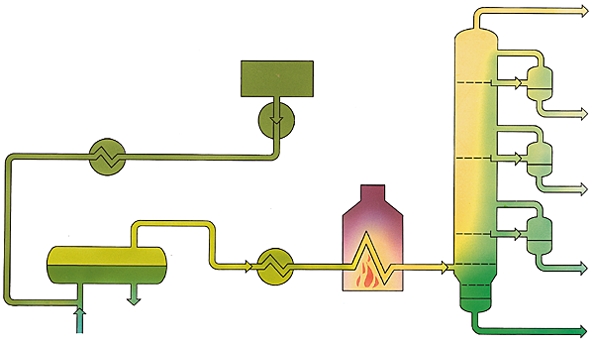
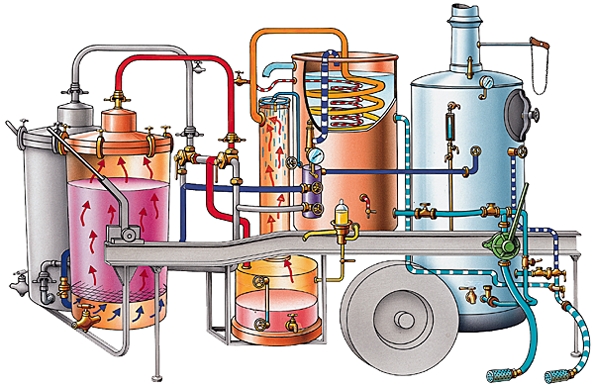
Dans une raffinerie, le pétrole brut subit d'abord une distillation fractionnée qui aboutit à une dizaine de coupes pétrolifères de base. Leurs caractéristiques sont ensuite améliorées par les installations de conversion ou d'épuration.
Sommairement, on obtient, par volatilité décroissante, les produits suivants :
– gaz combustible (C1, C2),
– coupe propane (C3),
– coupe butane (C4),
– essence légère (C5, C6, ou 20-80 °C),
– essence lourde (C7 à C10 ou 80-100 °C),
– kérosène (180-230 °C),
– deux ou plusieurs gasoils (230-380 °C),
– plusieurs distillats (380-500 °C),
– un résidu sous vide (plus de 550 °C).
Le résultat est obtenu par la mise en œuvre de trois opérations : la distillation atmosphérique du pétrole brut, la séparation des gaz et des essences, la distillation sous vide du résidu atmosphérique.