chimie organique

Branche de la chimie consacrée à l’étude du carbone et de ses combinaisons.
Au sein de la chimie, la chimie organique occupe une place prépondérante, du fait de la variété et du nombre presque illimité de composés à base de carbone. Plus d’un million de corps sont connus et ce nombre ne cesse de croître, et cela bien que les composés organiques ne renferment qu’un très petit nombre d’éléments différents : outre le carbone, on trouve principalement de l’hydrogène, de l’azote, de l’oxygène, des halogènes et, plus rarement, du soufre, du phosphore, etc.
Le nombre quasi illimité des composés organiques s’explique en partie par la propriété que possède le carbone tétravalent (de valence 4) de former des chaînes linéaires ou cycliques, qui constituent le squelette de la molécule sur lequel se greffent un ensemble de groupes fonctionnels ou d’autres atomes. L’existence de divers types d’isomérie (plane, stérique, optique, etc.) augmente encore considérablement le nombre de molécules imaginables.
1. Histoire de la chimie organique
1.1. « Force vitale » et alchimie
Jusque vers le milieu du xixe siècle, la chimie organique est limitée aux substances extraites des organismes vivants. On pense à l’époque que les corps organiques possèdent une « force vitale » qui les différencie des substances minérales et qui explique le peu de ressemblances notées entre ces deux types de substances.
Les alchimistes, cherchant l’élixir de longue vie et la pierre philosophale, capable de changer les métaux en or, mélangent intimement tous les éléments qu’ils trouvent ; cependant, ils distinguent les substances qui n’ont aucun rapport avec le règne vivant, telles que le soufre ou le salpêtre, de celles qui proviennent des organes vivants : viscères de crapaud, venin de serpent, etc. Ils font donc la distinction entre la chimie minérale et la chimie organique, comme l’écrit d’ailleurs Nicolas Lémery dans son Cours de chymie en 1690.
1.2. Les découvertes du xixe siècle


Il est généralement admis que, élaborées par la « force vitale », les substances organiques forment une catégorie à part, et ne peuvent obéir aux mêmes règles que les substances minérales. La mise au point progressive de méthodes analytiques propres à l’étude des substances organiques par les chimistes français Eugène Chevreul, Louis Joseph Gay-Lussac, Louis Jacques Thénard, puis surtout par le chimiste allemand Justus von Liebig, va conduire le chimiste suédois Jacob Berzelius à étendre sa théorie électrique à la chimie organique (→ électrochimie). Mais Berzelius se heurte à une difficulté : la définition de la structure et de la polarité des radicaux, fondement de cette théorie.
On assiste à ce sujet, et pendant de nombreuses années, à d’interminables controverses, dont le résultat immédiat est qu’une même substance peut être représentée par plus de dix formules différentes.
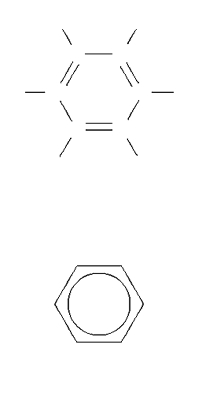
En prouvant que dans un composé organique l’hydrogène (substance électropositive) peut être remplacé par le chlore (substance électronégative), le chimiste français Auguste Laurent porte un coup fatal à la théorie électrique. De nombreux travaux de première importance vont conduire ensuite à adopter les formules développées et à comprendre le lien profond qui existe entre la structure réelle d’un composé et sa formule développée. Parmi ces travaux, on peut citer la découverte de la tétravalence du carbone et de la formule développée du noyau benzénique par August Kekulé von Stradonitz, la découverte de la dissymétrie moléculaire des substances optiquement actives par Louis Pasteur, la mise en lumière de la notion de carbone asymétrique par Joseph Le Bel et Jacobus Van’t Hoff, ou les études d’Alexandre Boutlerov sur la structure des composés organiques.
En 1828, le chimiste allemand Friedrich Wöhler réalise la synthèse de l’urée à partir du cyanate d’ammonium. L’urée étant considérée alors comme un corps essentiellement organique, puisque découvert dans l’urine, cette première synthèse d’un corps organique à partir d’une substance minérale étonne le monde des savants. Cette découverte fondamentale marque la fin de la théorie vitaliste et le début de la chimie organique moderne. Cependant, à l’époque, elle ne parvient pas totalement à imposer partout l’idée que la « force vitale » n’est pas nécessaire pour fabriquer des substances organiques.

De 1850 à 1865, le chimiste français Marcelin Berthelot, professeur au Collège de France, se consacre à la synthèse organique et reconstitue le méthane, l’alcool méthylique, l’acétylène et le benzène à partir de leurs éléments, et expose ses théories dans son livre intitulé Chimie organique fondée sur la synthèse (1860). Actuellement sont synthétisés environ un million de composés, parmi lesquels rares sont les produits que l’on trouve dans la nature.
2. La chimie du carbone
2.1. Liaisons simples et stabilité des composés organiques
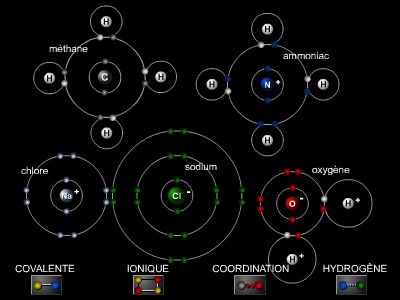
L’extraordinaire variété des composés étudiés en chimie organique tient à la propriété du carbone de pouvoir réaliser des liaisons de covalence avec lui-même et avec d’autres éléments comme l’hydrogène, l’oxygène et les halogènes. Le carbone permet ainsi de former des molécules de diverses tailles, notamment des macromolécules.
Les composés du carbone sont peu stables aux températures élevées ; en général, ils se décomposent à partir de 300 ou 400 °C ; le méthane (CH4), plus stable, commence à se décomposer en carbone et hydrogène vers 600 °C.
Suivant les conditions expérimentales, les produits de la décomposition peuvent être très variés ; plus une molécule est complexe, moins grande est sa stabilité thermique.
2.2. Liaisons multiples
L’atome de carbone peut également être réuni à d’autres atomes de carbone par des doubles liaisons (alcènes), des triples liaisons (alcynes) ou des liaisons plus complexes (délocalisation des électrons dans les composés aromatiques ou les diènes et polyènes conjugués). Cette faculté confère aux composés une réactivité remarquable et la possibilité d’introduire dans la molécule des hétéroatomes, notamment lors de réactions d’addition.
2.3. Les groupements fonctionnels
Un grand nombre de corps organiques possèdent un ensemble de propriétés communes ; ainsi se définit la notion de fonction, caractérisée par un groupement d’atomes : fonctions alcool (groupement OH), acide carboxylique (groupement COOH), etc. Dans la chaîne carbonée peuvent s’immiscer d’autres atomes, principalement d’oxygène ou d’azote.
3. Nomenclature des composés organiques
On commence par reconnaître le squelette d'atomes de carbone de la molécule et par lui attribuer un nom, qui dérive de la chaîne la plus longue si le composé n'est pas cyclique ou du cycle le plus grand si le composé est cyclique.
S'il existe des ramifications, on considère qu'elles correspondent au remplacement d'un ou de plusieurs atomes d'hydrogène par des radicaux sur un squelette de base. La présence de groupes fonctionnels est indiquée soit par des préfixes, soit par des suffixes : ainsi, hydroxy- est le préfixe et -ol le suffixe caractéristiques du groupe fonctionnel OH des fonctions alcool et phénol. Pour les radicaux comme pour les groupes fonctionnels, on fait suivre le préfixe ou le suffixe d'un chiffre indiquant la position sur le squelette de base, ce qui permet de distinguer les isomères (par exemple, les deux isomères du butane : CH3―CH2―CH2―CH3 et
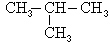 .
.
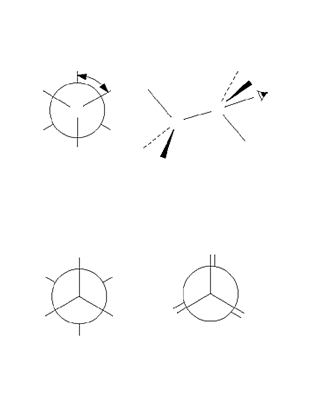
Sur cette nomenclature se greffe en outre une nomenclature stéréochimique relative aux configurations et aux conformations.
4. Les techniques de la chimie organique
4.1. L’analyse chimique des composés organiques
L’analyse chimique permet de connaître la nature et le nombre d’atomes présents dans le composé (détermination de la formule brute), ainsi que la position que les atomes occupent dans la molécule.

Pour cela, des méthodes chimiques sont utilisées ; on recherche des fonctions en provoquant des réactions chimiques caractéristiques (l’action du sodium sur un alcool permet de mettre en évidence l’hydrogène du groupement OH) et l’on peut dégrader des molécules complexes en molécules plus simples afin de les identifier plus facilement.
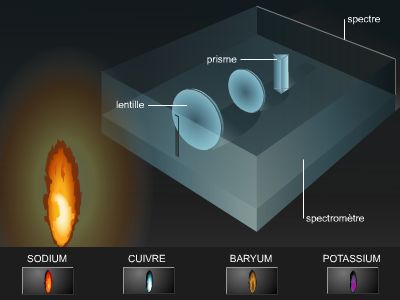
Les méthodes physiques de spectroscopie permettent de déterminer les formules développées des composés : les liaisons covalentes sont caractérisées par les spectres infrarouges et Raman, les liaisons multiples sont identifiées par les spectres ultraviolets, les atomes d’hydrogène sont comptabilisés grâce aux spectres de résonance magnétique nucléaire (RMN).
Pour s'assurer de la formule d’un composé, on emploie l’ensemble de ces méthodes, on compare les résultats obtenus et on vérifie les présomptions en faisant la synthèse de ce corps selon des méthodes éprouvées.
4.2. La synthèse chimique des composés organiques
Théoriquement, la synthèse est l’élaboration d’une substance à partir de corps simples. En fait, on peut considérer que l’on sait faire la synthèse totale d’un corps même si les produits de départ ne sont pas simples, à la condition que la synthèse de ces produits de départ soit connue. Ainsi, on considère que tous les corps obtenus à partir de l’acétylène sont synthétisés totalement, car on sait faire la synthèse de l’acétylène à partir du carbone et de l’hydrogène.
Les chimistes ont tenté la synthèse des composés organiques pour montrer que la « force vitale » n’était pas nécessaire. Le procédé s’est révélé fructueux, et la synthèse des produits naturels dont l’extraction et la purification sont difficiles est pratiquée couramment. Dans la chimie des colorants par exemple, les composés synthétiques ont supplanté les colorants naturels. On connaît l’importance de la synthèse des macromolécules (matières plastiques et polymères), issues de la carbochimie et de la pétrochimie.
Dans certains cas, la synthèse organique est plus difficile à réaliser que l’extraction des produits naturels. Il en est ainsi de la synthèse des protéines, catalysée par les enzymes, de la fabrication des molécules de sucre et de la fermentation alcoolique.
Les synthèses industrielles ont permis l’obtention d’innombrables produits de la vie courante : matières plastiques, colorants synthétiques, textiles artificiels, détergents, produits pharmaceutiques, parfums, etc. Les recherches se poursuivent pour améliorer les rendements, diminuer les prix de revient et augmenter les qualités de ces nouveaux produits. Pour cela, la chimie organique fait appel à d’autres sciences comme les mathématiques, la thermodynamique et la cinétique.
C’est en biologie que la chimie organique a permis les progrès les plus spectaculaires, avec la découverte de la structure des acides nucléiques et de certaines vitamines, hormones et protéines (biochimie).
5. L’évolution des théories en chimie organique
La chimie organique est une science expérimentale. Très vite, les chimistes ont essayé de dégager des théories permettant d’expliquer et de prévoir les réactions entre les composés. De la recherche des structures des molécules sont nées les théories de la valence et de l’isomérie.
De grands progrès ont été faits dans l’étude des mécanismes de réaction grâce à la théorie atomistique, qui permet de distinguer différents types de rupture des liaisons chimiques : rupture homolytique (radicalaire) lorsque chaque atome emporte un électron du doublet de valence, et rupture hétérolytique (ionique) lorsqu’un atome emporte le doublet électronique et devient un ion négatif tandis que l’autre atome se transforme en un ion positif. Enfin, la mécanique quantique ondulatoire a permis d’affiner encore les connaissances des mécanismes de réaction. Toutefois, toute hypothèse issue de ces théories doit être confirmée par l’expérience.
6. La chimie organique au cœur de l’industrie chimique
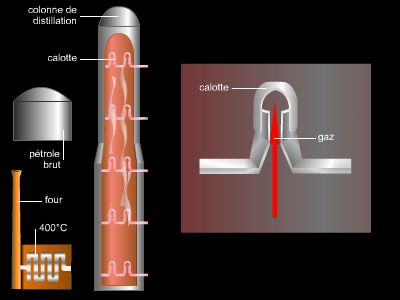
La chimie organique occupe une place majeure dans le monde industriel. Elle regroupe trois activités liées entre elles : la fabrication de produits chimiques organiques de base (éthylène, propylène, etc.), et en aval, la fabrication des matières plastiques de base (polyéthylènes, polypropylène, polychlorure de vinyle, polystyrène, etc.) et celle du caoutchouc synthétique et d’élastomères. Elle alimente ainsi de nombreux secteurs industriels, en particulier l’industrie pharmaceutique et la parachimie (cosmétiques et parfums), qui transforment ses produits de base. C’est une activité qui dépend fortement du pétrole qu’elle utilise à la fois comme matière première et comme source d’énergie. En effet, la chimie organique est une activité extrêmement énergivore.
La récente prise de conscience de l’inéluctable épuisement des ressources mondiales en énergies fossiles conduit les chimistes à explorer de nouvelles pistes de fabrication de bioproduits et ouvre la voie au développement de la « chimie verte ».