hydrocarbure

Composé formé uniquement de carbone et d'hydrogène. (Synonyme : carbure d'hydrogène.)
INDUSTRIE PÉTROLIÈRE
1. L'exploitation des hydrocarbures
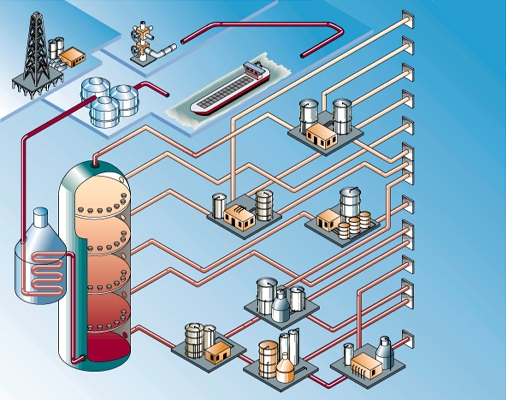
Du puits à la pompe, la chaîne de l'industrie pétrolière est devenue très exigeante en technologie et en capitaux, comme il est normal pour une industrie parvenue à maturité, qui fournit la principale source d'énergie de notre civilisation.
En début de chaîne (amont) se placent les deux phases de l'exploration et de la production. L'exploration consiste à déceler en sous-sol de possibles « pièges » à hydrocarbures, puis à prouver leur existence avec un ou deux forages accompagnés de tests. La production comporte elle-même une première phase de développement : nombreux forages et construction des infrastructures, suivie de l'exploitation proprement dite du gisement, soutenue par des opérations de stimulation (pompage, injection d'eau ou de gaz) jusqu'à son épuisement.
Les premiers gisements découverts et exploités étaient les plus accessibles. Au tournant du xxe s., les « wildcatters » américains, ces frères cadets des chercheurs d'or de la légende, se contentaient, dit-on, de forer là où retombait un chapeau jeté en l'air. Le développement exceptionnel de la demande pétrolière (20 Mt en 1900, 290 Mt en 1930, 3 Gt dans les années 1980) allait imposer aux compagnies un effort permanent d'adaptation. Elles ont appris à chercher, trouver et exploiter le pétrole dans les déserts, les forêts tropicales, les glaces et les mers profondes. Parallèlement, les conditions économiques sont devenues de plus en plus serrées. L'ère du pétrole facile et des gisements géants est révolue, d'autant que l'impact des hydrocarbures sur l'environnement (effet de serre, réchauffement climatique) conduit à développer des énergies alternatives.
Désormais, il est important de connaître avec une précision accrue la géologie des gisements, d'affiner les méthodes d'investigation, de maintenir ou d'accroître les chances de succès, malgré la réduction globale du potentiel de découverte. Simultanément, il faut inventer des outils et des concepts nouveaux pour rendre économiquement viables des exploitations qui ne l'étaient pas hier. L'exemple est donné par le pétrole marin (30 % de la production mondiale actuelle).
Tel est aussi le cas du gaz naturel, simple sous-produit autrefois brûlé sur place, aujourd'hui de plus en plus recherché et valorisé pour lui-même.
2. Dates de l'exploitation du pétrole
3. Les gisements d'hydrocarbures

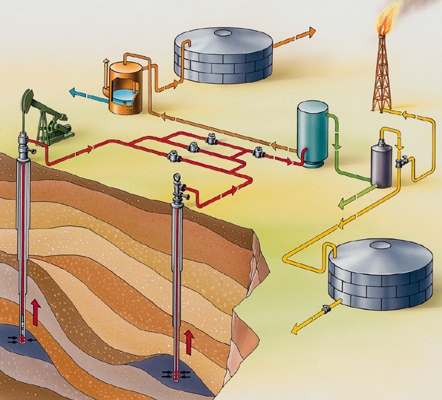
Le pétrole n'a d'intérêt que s'il forme un gisement. Un gisement est le terme d'une série de circonstances favorables s'échelonnant sur des centaines de millions d'années.
Les hydrocarbures naissent dans les roches mères : à l'origine, des vases déposées en milieu calme (lagunes, deltas, fonds marins). La matière organique (algues microscopiques) s'y fossilise en kérogène conservant, faute d'oxygène, son carbone et son hydrogène. Sous le poids des sédiments qui s'accumulent, les vases se compactent et s'enfouissent dans le sous-sol. La chaleur s'accroît avec la profondeur : le kérogène est lentement cuit, craqué en molécules d'hydrocarbures plus petites, comme un pot-au-feu qui perd sa graisse en gouttelettes. La maturation commence vers 65 °C : en deçà, la roche mère est immature (schistes bitumineux). Au-delà de 100 °C se forme le pétrole léger ; au-dessus de 135 °C, il est lui-même craqué en gaz (→ gaz de schiste).
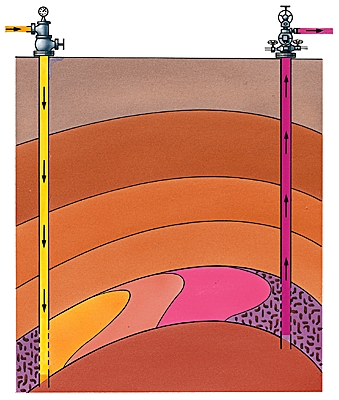
Sitôt formés, les hydrocarbures tendent à quitter la roche mère, se concentrent, cheminent vers le haut par toutes les voies offertes : roches poreuses, fissures. Ils atteignent la surface et s'oxydent (suintements de bitume, « feux sacrés » de gaz en Iraq), sauf si la migration est arrêtée par une couche imperméable (argile, sel gemme) : la couverture. Piégés, les hydrocarbures s'accumulent alors dans les interstices de la roche qui forme réservoir (calcaires, grès).
Un bon réservoir pétrolier a une porosité de 12 à 20 % ; il doit aussi être perméable, des fissures plus ou moins interconnectées permettant la circulation des fluides à l'intérieur de la roche. L'épaisseur de la couche varie de quelques mètres à quelques dizaines de mètres. En moyenne, seulement 25 % des réserves d'huile en place seront récupérées, l'éruptivité naturelle du gisement variant selon la qualité du réservoir et la présence plus ou moins grande de gaz. La productivité peut être accrue par injection d'eau, de gaz ou de produits tensioactifs.
4. Les méthodes de recherche d'hydrocarbures
L'exploration pétrolière est une démarche à la fois intellectuelle et opérationnelle. Pour forer « intelligemment », il faut d'abord « comprendre » le mieux possible un bassin sédimentaire.
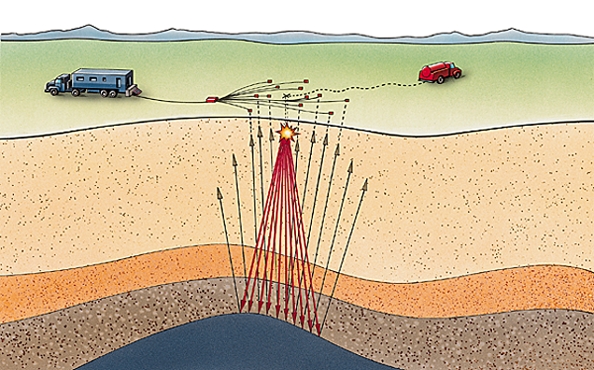
La géologie de surface donne une première idée de la configuration du sous-sol : étude cartographique, analyse des sédiments, des photos par avion ou par satellite. Le but est de déterminer la zone où les méthodes géophysiques, précises mais coûteuses, seront le mieux utilisées. Parmi les principales méthodes figurent : la magnétométrie (enregistreur remorqué par un avion), la mesure de la résistivité électrique des terrains, la gravimétrie et, surtout, la sismique (qui représente 90 % du budget de recherche).
La sismique consiste à provoquer de légers ébranlements à la surface du sol : les ondes émises progressent à des vitesses variables selon les terrains traversés et se réfléchissent sur les discontinuités, qui jouent le rôle d'un miroir. Les enregistrements obtenus, véritable échographie sur les couches profondes du sol, permettent de déterminer la disposition et la nature de ces couches, de localiser des anomalies qui peuvent être des pièges à hydrocarbures. Le traitement des signaux par ordinateur et la mise au point récente de la sismique « 3D » (trois dimensions), qui fournit des images analogues aux tomographies médicales, autorisent parfois la lecture directe de la présence d'hydrocarbures. Les ondes de choc sont provoquées par des explosifs en zone désertique et par des camions vibrateurs opérant en série pour les régions habitées. En mer, on a recours à l'implosion d'une bulle de vapeur, inoffensive pour l'environnement.
5. Le forage
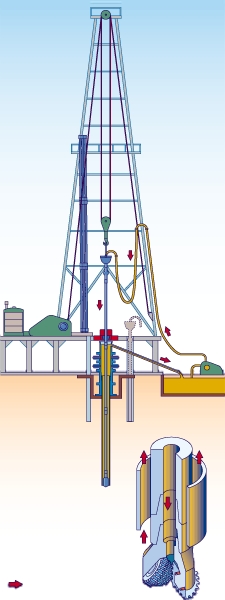
Le forage d'exploration est positif une fois sur dix. Il exige un déploiement logistique important (communication, matériel lourd, gros volumes d'eau).
Le forage ou sondage est un trou de diamètre décroissant (60 à 10 cm) dirigé vers un objectif à quelques centaines de mètres ou quelques kilomètres (3 km en moyenne). La vitesse d'avancement varie avec les terrains : en moyenne 35 % du temps pour la progression de l'outil et 65 % pour les manœuvres (remplacement d'un trépan usé, remontée des tiges). Le forage est le seul moyen de prouver qu'une structure contient bien des hydrocarbures et d'en évaluer le potentiel productif. Tout au long des opérations, les géologues étudient les déblais ramenés au jour avec les fluides de forage (boues) et font des prélèvements de roches, analysés en laboratoire. Des sondes descendues par câble opèrent des mesures électriques, radioactives et soniques.
L'outil de forage (trépan) est entraîné par le train de tiges depuis la table de rotation (forage rotary) ou bien directement par une turbine mue par la pression des boues envoyées par les pompes en surface. Depuis quelques années, on sait également pratiquer le forage dévié (plusieurs trous à partir d'un même site) et le forage horizontal.
6. L'offshore
Les gisements sous-marins fournissent actuellement 30 % de la production mondiale de pétrole. L'industrie pétrolière offshore exige un matériel lourd spécifique (plates-formes, systèmes d'évacuation des hydrocarbures) et un effort sans cesse renouvelé d'innovation technologique (sécurité, environnement, réduction des coûts).
Le forage s'effectue à partir de supports mobiles. La plate-forme autoélévatrice, utilisable par 100 m d'eau, prend appui sur le fond et se hisse sur ses jambes grâce à des vérins. La plate-forme semi-submersible, montée sur flotteurs, est ballastée puis ancrée par des chaînes sur le lieu du forage (400 m d'eau maximum) ; elle peut affronter des vents de plus de 200 km/h et des creux de 25 m. Pour les très grandes profondeurs (1 000 m et plus), le navire de forage à positionnement dynamique est seul possible ; il est muni d'hydrophones qui captent les signaux acoustiques émis par des bouées placées sur le fond marin ; un ordinateur corrige en permanence la position du navire qui se maintient à l'aplomb de son emplacement en jouant de ses hélices principales et latérales.

Les installations de production, elles, sont nécessairement fixes, d'où les coûts très élevés qui croissent avec les contraintes de l'environnement. Les plates-formes comprennent des modules de production, notamment de première séparation du gaz et de l'huile, et d'habitation. Les liaisons courantes sont assurées par hélicoptère. L'évacuation des productions vers la côte peut être assurée par un tanker reconverti si les volumes d'huile sont modestes. Autrement, il faut poser des conduites sous-marines à partir de barges où les tronçons sont soudés au fur et à mesure. Une fois en place, les oléoducs sont ensouillés à l'aide d'une machine à air comprimé qui creuse une tranchée d'un mètre pour les abriter des chaluts. L'entretien et la réparation des conduites sous-marines sont, depuis le début des années 1990, l'objet d'un effort intense d'innovation technologique : robots télécommandés permettant d'opérer au-delà des limites des plongeurs (300 à 400 m en pratique), systèmes d'intervention épargnant la mise en eau générale de la canalisation (et donc un long arrêt de production).
D'une manière générale, dans les milieux difficiles, comme la mer du Nord, la tendance est à l'automatisation et à la télécommande des installations, c'est-à-dire à leur allégement. Des pétroliers français et norvégiens ont mis au point un système de production « tout au fond » qui devrait permettre bientôt d'envisager le développement de nouveaux gisements sans construction de plates-formes fixes.
7. Le transport du gaz naturel
Énergie diffuse, le gaz naturel doit être concentré pour voyager sur de grandes distances. Les fractions lourdes (propane, butane, pentane) sont faciles à condenser en produits liquides (gaz de pétrole liquéfiés [G.P.L.], gaz naturel liquéfié [G.N.L.]). Les fractions légères (méthane) exigent des installations complexes : gazoducs, terrestres ou sous-marins, acheminant le gaz à haute pression (140 bars en mer du Nord), ou « chaînes du froid », assurant le commerce transocéanique (exemple : Alaska, Indonésie, Abu Dhabi-Japon). Le gaz y est liquéfié en usines côtières à −160 °C et à pression atmosphérique, réduit à 1/600 de son volume, stocké, transporté par méthaniers, restocké à destination, puis revaporisé avant utilisation finale.
CHIMIE ORGANIQUE
1. Diversité des hydrocarbures
1.1. Les hydrocarbures dans la nature
Minéral. À l’état naturel, les hydrocarbures les plus importants et les plus connus se rencontrent dans le règne minéral, sous forme de pétroles et de gaz naturels, qui sont des mélanges complexes d’hydrocarbures.
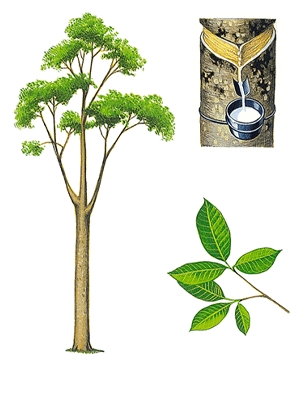
Végétal. Le règne végétal produit également des hydrocarbures très particuliers, les terpènes. Ceux-ci sont des constituants le plus souvent odoriférants (citronnelle, camphre, térébenthine, etc.), extraits sous la forme d’huiles essentielles. On trouve également des pigments, comme le carotène, et du latex (extrait du caoutchouc naturel, polymère naturel de l’isoprène). On notera également que le méthane se forme par suite de la fermentation des végétaux.
Animal. Dans le règne animal, des hydrocarbures particuliers sont produits dans certaines glandes, tel le squalène, que l’on trouve notamment dans l’huile de foie de requin.
Pour leurs applications, importantes dans la vie de l’homme, de nombreux hydrocarbures ont été reproduits par synthèse.
1.2. Caractéristiques chimiques des hydrocarbures
Les hydrocarbures ne contiennent dans leur molécule que des atomes de carbone et d’hydrogène. Ils forment une classe qui comprend de très nombreux composés (plusieurs centaines de milliers). Suivant leur structure, les chimistes distinguent plusieurs types : les hydrocarbures acycliques (ou aliphatiques, à chaîne ouverte) saturés et insaturés, et les hydrocarbures cycliques saturés et insaturés.
2. Les hydrocarbures acycliques
Cette famille d’hydrocarbures, qui regroupe les alcanes, les alcènes et les alcynes, est l’une des plus importantes en chimie organique industrielle.
2.1. Les hydrocarbures acycliques saturés
Dénommés également paraffines, de formule générale CnH2n+2, les hydrocarbures acycliques saturés sont désignés sous le nom générique d’alcanes. On peut les représenter symboliquement par la notation RH, où R correspond à un groupe alkyle (CnH2n+1). Ils ne comportent que des liaisons carbone-carbone simples. Cependant, selon la nature et la structure de leurs chaînes carbonées, on distinguera les alcanes à chaîne carbonée linéaire et les alcanes ramifiés.
2.1.1. Les alcanes linéaires
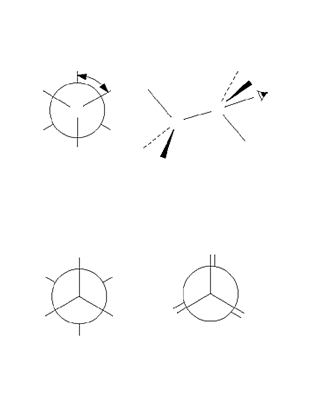
Selon la nomenclature officielle de l’IUPAC (International Union of Pure and Applied Chemistry), le nom d’un alcane linéaire est donné par la chaîne carbonée la plus longue (chaîne principale) : méthane (CH4), éthane (C2H6), propane (C3H8), butane (C4H10), pentane (C5H12), etc.
Leurs points d’ébullition ou de fusion augmentent régulièrement avec la masse moléculaire. Ainsi, du méthane au butane, ce sont des gaz dans les conditions ordinaires, puis, à partir du pentane jusqu’à l’hydrocarbure en C16, ce sont des liquides, avec un point d’ébullition de plus en plus élevé, et, à partir de C17, des solides dont le point de fusion ne dépasse pas 100 °C.
2.1.2. Les alcanes ramifiés
Les chaînes latérales (groupes alkyles) sont désignées par des préfixes accolés au nom de la chaîne carbonée linéaire la plus longue et précédés des indices de position correspondants. Par exemple, le 2-méthylbutane a la formule semi-développée suivante :
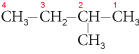
La ramification de la chaîne abaisse les températures de fusion et d’ébullition. Ces alcanes présentent l’isomérie de position à partir du terme en C4 (dans l’exemple précédent, la ramification se trouve sur le carbone d’indice 2, soit le 2-méthylbutane) et l’isomérie optique (apparition du pouvoir rotatoire) à partir de C7.
2.1.3. Réactivité des alcanes

Les alcanes sont caractérisés par une grande inertie chimique vis-à-vis de la plupart des réactifs. Ils ne donnent pas de réactions d’addition, mais réagissent par substitution radicalaire avec des réactifs générateurs de radicaux, tels les halogènes : le chlore et le brome (sous irradiation ou à haute température), le fluor (réaction violente). Ainsi, avec le méthane, il se forme successivement : CH3Cl, CH2Cl2, CHCl3 puis CCl4.
Ces réactions de substitution ne sont pas sélectives, et n’importe quel hydrogène d’un alcane peut être substitué. La substitution des hydrocarbures ramifiés est d’autant plus facile que l’atome de carbone intéressé porte davantage de groupes alkyles. La nitration directe, formation directe de dérivés R–NO2, ne s’effectue qu’en phase vapeur et avec quelques termes seulement ; la sulfonation, formation directe de dérivés R–SO3H, est très difficile.
Ce sont des combustibles d’une grande importance pratique, leur réaction avec l’oxygène provoquant un important dégagement de chaleur :
2 CnH2n+2 + (3n + 1) O2 → 2n CO2 + (2n + 2) H2O
2.2. Les hydrocarbures acycliques insaturés
Ces hydrocarbures, les alcènes et les alcynes, ont, à la différence des alcanes, un site réactif : une double ou une triple liaison.
2.2.1. Les alcènes (ou oléfines)
De formule générale CnH2n, ils comportent une ou plusieurs doubles liaisons. La nomenclature des alcènes dérive de celle des alcanes, la terminaison en -ane étant remplacée par une terminaison en -ène (éthène [C2H4], propène [C3H6], etc.).
Comme ils renferment une double liaison, ils présentent, à partir du terme en C4, des isoméries de position et de géométrie (existence de deux isomères correspondant à des dispositions relatives différentes des groupes alkyles sur la double liaison).
Ainsi, pour le but-2-ène, on a les deux isomères suivants : le cis-but-2-ène (les substituants prioritaires sont du même côté du plan formé par la double liaison et le trans-but-2-ène (substituants prioritaires de part et d’autre de la double liaison) :
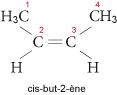 et
et
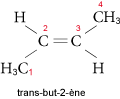
2.2.2. Réactivité des alcènes
Les alcènes sont caractérisés par une plus grande réactivité chimique que les alcanes. Ce sont surtout des réactions d’addition électrophile qui se produisent sur la double liaison avec l’action de divers réactifs dits électrophiles (H2O, HCl, HOCl, halogènes, etc.) : ces derniers sont générateurs d’espèces présentant une déficience électronique, en général des cations.
Avec les alcènes non symétriques (RCH=CHR′ et RR′C=CR′′R′′′), la réaction est stéréospécifique, et on obtient deux produits différents en quantités inégales : la réaction présente une régiosélectivité. En outre, les deux fragments du réactif électrophile (cation, puis anion) se fixent de part et d’autre du plan de la double liaison (trans-addition) selon la règle de Markovnikov (le cation se fixe préférentiellement sur l’atome de carbone portant le plus petit nombre de substituants alkyles R). Sous certaines conditions, le mécanisme peut être inverse (effet Kharasch).
Les alcènes, en présence de catalyseurs, fixent également l’hydrogène pour donner des alcanes :
RCH=CHR′ + H2 → RCH2–CH2R′
L’addition de monoxyde de carbone en présence d’hydrogène et de catalyseurs conduit aux aldéhydes (réaction oxo). L’oxydation des alcènes par divers réactifs chimiques correspond également à une addition sur la double liaison.
De nombreuses réactions d'addition et de substitution sont possibles, avec coupure ou non de la chaîne carbonée. Mais cette facilité des alcènes à réagir a aussi des désavantages, car ils s’oxydent facilement à l’air donnant des composés instables (vieillissement du caoutchouc, rancissement des graisses, etc.).
Cependant, du fait des multiples possibilités de réactions d’addition des alcènes, on réalise des réactions de polymérisation, en présence de catalyseurs, pour la préparation industrielle du polyéthylène et du polypropylène.
2.2.3. Les polyènes (ou polyoléfines)
Ces hydrocarbures renferment plusieurs doubles liaisons. Parmi les diènes (deux doubles liaisons), on rencontre :
• les hydrocarbures alléniques, à doubles liaisons dites cumulées, aboutissant à un même atome de carbone, tel l’allène CH2=C=CH2 ;
• les diènes conjugués qui contiennent deux doubles liaisons séparées par une liaison simple, comme le buta-1,3-diène CH2=CH–CH=CH2 ;
• les diènes à liaisons indépendantes : CH2CH[CH2]nCHCH2 (avec n ≥ 1).
Les diènes conjugués présentent des propriétés particulières telles que l’addition-1,4 de divers réactifs avec la formation d’une double liaison en 2,3 (en plus de l’addition normale sur une double liaison).
Les diènes conjugués donnent aussi des réactions de cycloaddition (dites de Diels-Alder) avec des composés comportant une double liaison qui est activée par la présence d’un groupe carbonyle, carboxyle, etc. (philodiènes).
La polymérisation des diènes conjugués conduit à des polymères dotés de propriétés mécaniques intéressantes (élastomères).
Les hydrocarbures insaturés sont parfois colorés. Ainsi, quand ils contiennent un système de doubles liaisons conjuguées du type R–[CH=CH–CH=CH]n–R′, ils présentent une absorption de la lumière qui se déplace de l’ultraviolet vers le visible lorsque le nombre n de doubles liaisons conjuguées croît (effet bathochrome). Ainsi :
• les hydrocarbures sont incolores jusqu’à n = 4 ;
• pour n = 5 et 6, ils sont jaune pâle ;
• pour n = 7 à 10, ils sont jaunes ;
• à partir de n = 11, ils sont orangés (caroténoïdes).
2.2.4. Les alcynes (hydrocarbures acétyléniques)
De formule générale CnH2n–2, les alcynes se caractérisent par la présence d’une triple liaison dans la molécule.
Selon qu’il existe un ou deux groupes alkyles, on classe les alcynes en deux groupes :
• les alcynes monosubstitués (ou vrais) de formule R–C≡C–H ;
• les alcynes disubstitués de formule R–C≡C–R′ (les radicaux R et R′ pouvant être identiques ou différents).
Comme les alcènes, ils réagissent par addition électrophile, mais la présence de la triple liaison fait que la réaction s’accomplit en deux temps : il y a d’abord une formation intermédiaire de composés à double liaison éthylénique, puis ceux-ci subissent une nouvelle addition qui se réalise également selon la règle de Markovnikov.
En réagissant avec l'eau, l’acétylène conduit à de l’acétaldéhyde (CH3–CHO). Les autres alcynes vrais forment des cétones. Par ailleurs, les alcynes vrais ont un caractère acide.
Les alcynes, du fait de leur grande réactivité, donnent des réactions de polymérisation. Tel est surtout le cas avec l’acétylène qui, selon les conditions opératoires, forme du vinylacétylène ou encore des composés cycliques (benzène C6H6).
Enfin, la triple liaison des alcynes peut subir une oxydation en présence d’oxydants énergiques (acide chromique par exemple), conduisant à une coupure de la molécule avec formation de deux acides carboxyliques :
R–C≡C–R′ → R–COOH + R′–COOH
3. Les hydrocarbures cycliques
C’est la présence d’une ou de plusieurs chaînes carbonées cycliques dans la molécule qui les caractérise. Ces chaînes peuvent être saturées ou non saturées.
3.1. Les hydrocarbures monocycliques saturés (cyclanes)
De formule générale CnH2n, ils sont nommés en faisant précéder du préfixe cyclo le nom de l’alcane comportant le même nombre d’atomes de carbone : cyclopropane (en C3), cyclobutane (en C4), etc.
Leurs propriétés chimiques dépendent de la taille du cycle : ainsi, le cyclopropane, qui donne des additions avec ouverture du cycle, est plus réactif que le cyclobutane.
3.2. Les hydrocarbures monocycliques insaturés
De formule générale CnH2n−2, les cyclènes, ou cycloalcènes, comportent une double liaison et ont donc des propriétés chimiques qui rappellent celles des alcènes correspondants.
3.3. Les arènes, ou hydrocarbures aromatiques

Les arènes comportent un ou plusieurs cycles de type benzénique avec un nombre maximal de doubles liaisons dites conjuguées qui possèdent des propriétés particulières (aromaticité).
3.3.1. Les hydrocarbures aromatiques monocycliques
Ils comprennent le benzène et ses homologues, qui en dérivent par le greffage de différentes chaînes sur le cycle. Dans la molécule de benzène, les atomes du cycle participent à une liaison délocalisée avec six électrons π.
Le cycle plan est dit aromatique (règle de Hückel), et la molécule de benzène est dite hybride de résonance, car elle peut avoir différentes formules limites :
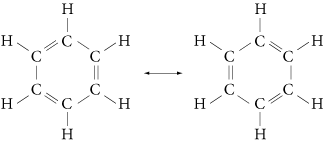
On la représente conventionnellement par :
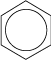
Cette délocalisation des liaisons π fait que les hydrocarbures aromatiques présentent une grande stabilité ; les réactions d’addition sont difficiles ; en revanche, les réactions de substitution électrophile avec de nombreux réactifs (halogènes, H2SO4, HNO3, etc.) sont faciles : le remplacement d’un hydrogène du cycle par un autre atome ou groupe d’atomes ne modifie pas la structure électronique du noyau benzénique. Avec Br2, le réactif électrophile est Br+ ; avec HNO3, NO2+ et avec H2SO4, SO3.
Les réactions de substitution avec les arènes ont besoin de catalyseurs (acides de Lewis, tels que AlCl3, FeCl3, etc.), afin de fixer l’ion non utilisé dans la réaction et de faciliter ainsi la fixation du réactif électrophile.
C’est une alkylation avec les halogénures d’alkyles (il y a substitution d’un H par un alkyle R, ce qui permet de lier une chaîne latérale à un cycle) et une acylation avec des acyles. Ces réactions sont importantes pour la synthèse organique, notamment pour la préparation d’alkylbenzènes et de cétones du type ArCOR (Ar désignant un groupe aryle).
Une première substitution n’engendre pas de problème d’orientation, car les six carbones sont identiques. En revanche, lors d’une deuxième substitution, avec l’introduction d’un deuxième substituant sur un dérivé benzénique monosubstitué apparaissent des isomères de position (ortho, méta, para) dont la proportion n’est pas égale. Ce dernier aspect dépend du substituant présent, qui, selon sa nature, influence la facilité de la réaction (règles de Hollemann).
Ainsi, des substituants comportant des hétéroatomes porteurs de doublets électroniques libres orientent la réaction en ortho et en para (formation de dérivés 1,2 et 1,4-disubstitués) : OH, NH2, les groupes alkyles R exercent cette influence, tandis que les substituants comportant des liaisons multiples orientent en méta (formation de dérivés 1,3-disubstitués) : NO2, SO3H, COR, COOH, CN agissent de cette façon.
Le benzène peut donner cependant des additions radicalaires (addition de réactifs générateurs de radicaux) : sous irradiation, il fixe du chlore pour former C6H6Cl6, dont l’un des isomères est un insecticide, le lindane). Le benzène est hydrogéné en cyclohexane en présence de catalyseurs.
Les homologues du benzène (mono- et polyalkylbenzènes) sont plus sensibles que le benzène aux réactions de substitution.
Ainsi, avec le toluène C6H5CH3, le chlore en présence de catalyseurs conduit à un mélange d’ortho- et de para-chlorotoluènes, tandis qu’à chaud, en l’absence de catalyseurs, il se forme du chlorure de benzyle (C6H5CH2Cl).
Parmi les hydrocarbures benzéniques à chaîne latérale insaturée, le styrène (C6H5CH=CH2) donne lieu à une réaction de polymérisation (polystyrène).
3.3.2. Les hydrocarbures aromatiques polycycliques
Ce sont des hydrocarbures à cycles unis par un sommet (biphényle C6H5–C6H5) ou par une chaîne hydrocarbonée (diphénylméthane (C6H5)2CH2, triphénylméthane (C6H5)3CH, base de nombreux colorants) et les hydrocarbures à noyaux condensés (comportant plusieurs cycles accolés).
Premier terme de la série naphtalénique (CnH2n−12), le naphtalène comporte deux cycles :
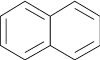
Pour les hydrocarbures aromatiques polycycliques, la coloration apparaît à partir de quatre cycles benzéniques accolés linéairement ; l’accolement de cycles conduit en effet à un système conjugué plus important : le tétracène est jaune orangé, et le pentacène est bleu.