solution

Mélange homogène constitué d’au moins deux substances.
CHIMIE

Une grande partie de la chimie s’effectue en solution. En effet, très souvent les réactions chimiques se déroulent en solution pour deux raisons principales : d’une part, la mise en solution assure un bon contact entre les réactifs lorsqu’ils ne sont pas naturellement miscibles ; et d’autre part, la mise en solution permet de faire intervenir des quantités de réactifs mesurées avec grande précision (par exemple, lors de dosages ou de titrages) ; de plus, elle offre la possibilité de contrôler la vitesse des réactions en agissant sur les concentrations.
1. Solutions, solvant et soluté

Dans une solution, la substance présente en plus grande quantité est couramment appelée solvant. La substance en plus faible quantité est dite dissoute et est appelée soluté. Le soluté peut être un gaz, un liquide, un solide, et le solvant peut être soit liquide, soit solide (états de la matière). Les boissons gazeuses, constituées principalement d’eau (solvant) et de dioxyde de carbone dissous (soluté), ou l’eau de mer (solvant) contenant divers sels (solutés), sont des exemples de solutions liquides.
Les mélanges de gaz, tels que l’atmosphère, sont parfois considérés comme des solutions ; on parle alors de solutions gazeuses.
Les solutions diffèrent des colloïdes et des suspensions, dans lesquelles les particules du soluté sont de taille moléculaire et sont dispersées de manière homogène dans le solvant. Les solutions paraissent homogènes au microscope, et le soluté ne peut être séparé par filtration.
Certains métaux sont solubles l’un dans l’autre à l’état liquide et se solidifient. Si un tel mélange peut se solidifier pour différentes proportions des deux métaux (alliage), on dit que ces derniers forment une solution solide.
2. Notion de solubilité

La solubilité d’un composé dans un solvant donné – à température et pression données – est la quantité maximale du composé qui peut être dissous dans la solution (dissolution). Autrement dit, la solubilité est égale à la concentration maximale (molaire ou massique) d’un soluté dans une solution. Lorsque la concentration est égale à la solubilité, la solution est dite saturée en soluté : on ne peut plus y dissoudre une quantité supplémentaire de soluté. Par exemple, si l’on considère une solution aqueuse contenant du sucre dissous, au-delà d’une certaine quantité de sucre rajouté à la solution, il n’y a plus dissolution de ce dernier : la solution est saturée en sucre. De même, dans un marais salant, l'évaporation de l'eau augmente la concentration en sel jusqu'à saturation, ce qui permet sa récolte.
De manière générale, la solubilité de la plupart des substances augmente avec la température du solvant. Toutefois, pour certaines substances telles que les gaz ou les sels organiques de calcium, la solubilité dans un liquide augmente lorsque la température diminue. Par ailleurs, les solutions dont les molécules du soluté ont une structure chimique similaire à celles du solvant ont en général une solubilité très élevée. Par exemple, les alcools de formule générale R–OH et l’eau (HOH) sont extrêmement solubles l’un dans l’autre.
3. Caractéristiques et propriétés physiques des solutions
3.1. Concentration du soluté apporté
La caractéristique essentielle d’une solution est sa concentration en corps dissous (soluté) qui peut se définir des façons suivantes :
• masse de soluté par unité de volume de solution :
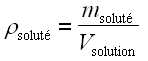 ; la concentration s’exprime alors en kilogrammes par mètre cube (kg.m–3) ou parfois en grammes par litre (g.L–1) ;
; la concentration s’exprime alors en kilogrammes par mètre cube (kg.m–3) ou parfois en grammes par litre (g.L–1) ;
• nombre de moles de soluté par unité de volume de solution :
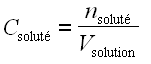 ; la concentration ainsi définie porte le nom de molarité et s’exprime généralement en moles par litre (mol.L–1) ou en moles par mètre cube (mol.m–3).
; la concentration ainsi définie porte le nom de molarité et s’exprime généralement en moles par litre (mol.L–1) ou en moles par mètre cube (mol.m–3).
3.2. Caractéristiques d’une solution ionique et concentration effective des ions en solution
Lorsque l’on dissout un solide ionique dans l’eau, on obtient une solution aqueuse ionique constituée d’anions et de cations dispersés et en mouvement parmi les très nombreuses molécules d’eau.
Les solutions ioniques sont électriquement neutres mais conduisent le courant électrique, car elles possèdent des ions solvatés qui sont des charges mobiles. Une solution conductrice du courant électrique est appelée électrolyte. Les solutions aqueuses ioniques sont donc des électrolytes.
On caractérise les solutions ioniques à l'aide d'une formule qui fait apparaître le type et les proportions des ions présents dans le solvant. Par exemple, la formule de la solution ionique de fluorure de calcium est (Ca2+(aq) + 2 F–(aq)).
Enfin, on note [X] la concentration effective d’un ion X présent en solution :
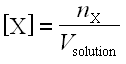 ; elle s’exprime en moles par litre (mol.L–1).
; elle s’exprime en moles par litre (mol.L–1).
La concentration des ions hydronium (H3O+) permet de calculer le pH d’une solution aqueuse, c’est-à-dire son caractère acide ou basique, par la formule pH = – log [H3O+].
3.3. Points d’ébullition et de congélation

Lorsqu’un soluté est ajouté à un solvant, certaines propriétés physiques du solvant se modifient : son point d’ébullition augmente et son point de congélation diminue lorsque la concentration du soluté augmente. Par exemple, on ajoute un antigel tel que l’éthane-1,2-diol (HOCH2CH2OH) dans l’eau de refroidissement d’un moteur pour empêcher celle-ci de geler. De même, un iceberg constitué d'eau douce reste solide tandis qu'à la même température l'eau de mer salée ne gèle pas.
3.4. Pression osmotique
Les solutions ont une autre propriété importante : elles peuvent exercer une pression osmotique. Si deux solvants sont séparés par une membrane semi-perméable (membrane laissant passer les molécules du solvant, mais empêchant le passage des molécules du soluté), les molécules de solvant migrent de la solution de plus faible concentration vers la solution de concentration la plus élevée, rendant cette dernière plus diluée (phénomène d’osmose particulièrement important en physiologie et en biologie cellulaire pour expliquer les échanges chimiques au sein des organismes vivants).